Ο Κυτταρικός Κύκλος είναι οι φάσεις της ζωής όσων κυττάρων ανανεώνονται μίτωση αυτοδιαίρεση . Η μίτωση χρησιμοποιείται για ανανέωση αυτοδιπλασιασμό, σχεδόν από όλα τα σωματικά κύτταρα στο ενήλικο σώμα, εκτος από τα τελικώςδιαφοροποιημένα κύτταρα που είτε αντικαθίστανται από βλαστοκύτταρα σε βλάβη τους είτε δεν αντικαθίστανται ποτέ και από όσα κύτταρα ανανεώνονται από τα βλαστοκύτταρα του αίματος,δερματικά κερατινο κύτταρα. Τα σπερματοζωάρια και τα ωάρια δημιουργούνται από τα προγονικά γεννητικά τους κύτταρα, με άλλο τρόπο που λέγεται μείωση.
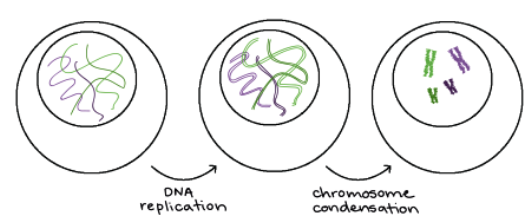
Οι φάσεις του κυτταρικού κύκλου είναι δυο, αρχικά προηγείται η μεσόφαση και ακολουθεί η μίτωση δηλαδή η διαίρεση του κυττάρου σε δύο πανομοιότυπα θυγατρικά κύτταρα με 46 χρωματοσώματα.
Στη μεσόφαση το κύτταρο αναπτύσσεται, διπλασιάζει το κυτταρόπλασμα και τα οργανίδια του (σε δυο φάσεις) και διπλασιάζει το DNA του, σε 92 χρωματοσώματα (φάση της σύνθεσης).
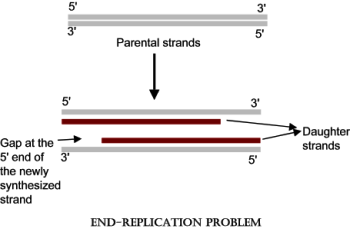
Δυστυχώς όμως, υπάρχει μια εγγενής αδυναμία στην πλήρη, μέχρι την άκρη, σύνθεση- αντιγραφή
(λέγεται end replication problem)
της μιας από τις 2 θυγατρικές έλικες lagging strand του DNA σε κάθε αναδιπλασιασμό του στη φάση της σύνθεσης, οπότε ένα τμήμα της χάνεται, κάθε φορά που το κύτταρο πρόκειται να διαιρεθεί.
Γι’ αυτό φύση, Θεός, φρόντισαν σε κάθε μια από τις δυο άκρες των 46 χρωματοσωμάτων, να υπάρχει αναλώσιμο DNA ώστε να χάνεται από αυτό ένα τμήμα, αντί να χάνεται από το χρήσιμο DNA που είναι κεντρικότερα.
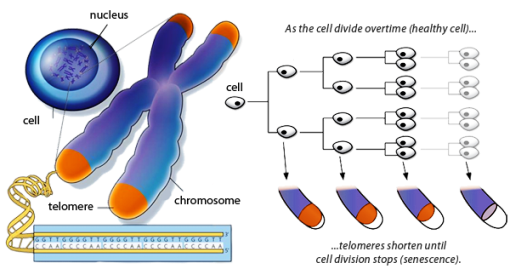
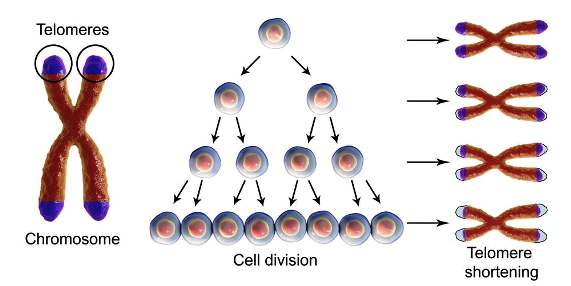
Αυτές οι προστατευτικές άκρες λέγονται τελομερή.
Οι διαιρέσεις των πιο πάνω κυττάρων σταματούν όταν τα τελομερή των χρωματοσωμάτων τους φτάσουν σε κάποιο κρίσιμα μικρό μήκος, που έρχεται, σιγά- σιγά, μετά από διαδοχικές μειώσεις του μήκους τους, σε κάθε κυτταρική διαίρεση.
Η θυσία τμήματος των τελομερών σε κάθε κυτταρική διαίρεση, συμβαίνει για να μην χαθούν οι γενετικές πληροφορίες από το χρήσιμο DNA.Έτσι ο ανώτερος αριθμός των διαιρέσεων (μιτώσεων) των κυττάρων λέγεται Hayflick limit και είναι περίπου 40-70 στη διάρκεια της ζωής του ανθρώπου.
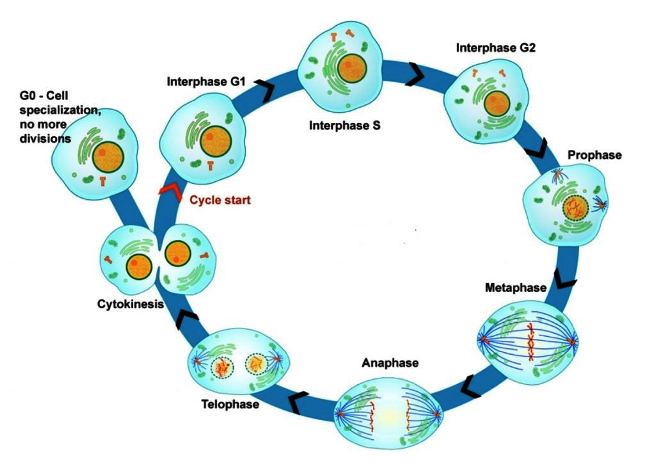
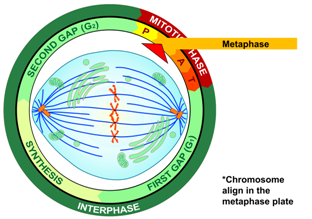
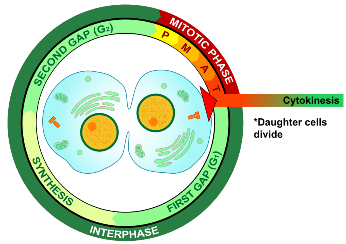
Ο κυτταρικός κύκλος, δηλαδή οι φάσεις της ζωής του κυττάρου, είναι δυο:
i) Η μεσόφαση, όπου το κύτταρο αυτο-διπλασιάζει το DNA του και τα υπόλοιπα οργανίδια του και
ii) η φάση της μίτωσης, όπου διαιρείται το κύτταρο σε 2 πανομοιότυπα θυγατρικά κύτταρα.
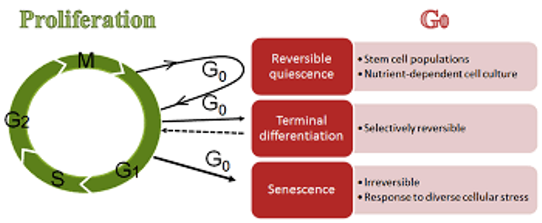
Όμως δεν βρίσκονται όλα τα σωματικά κύτταρα στον κυτταρικό κύκλο, μερικά βρίσκονται εκτός κυτταρικού κύκλου, σε φάση ηρεμίας (quiescent stage) ή φάση G μηδέν (G 0).
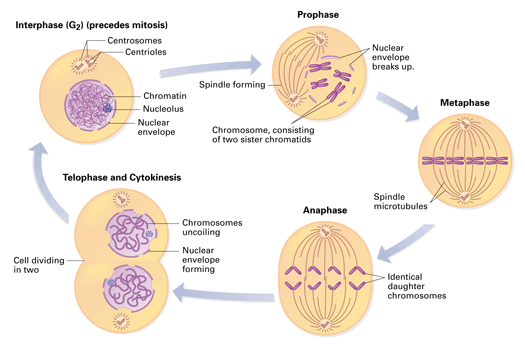
Η ΜΕΣΟΦΑΣΗ INTERPHASE
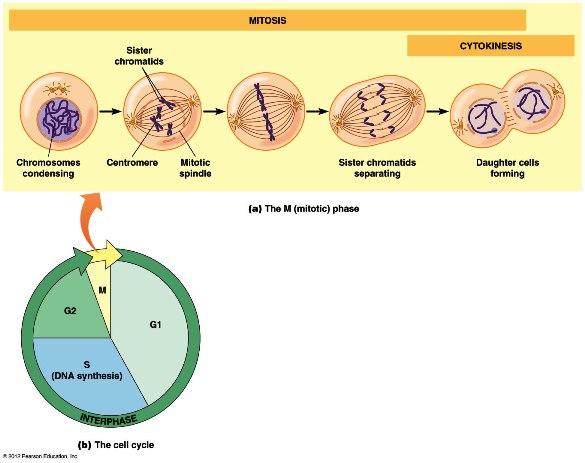
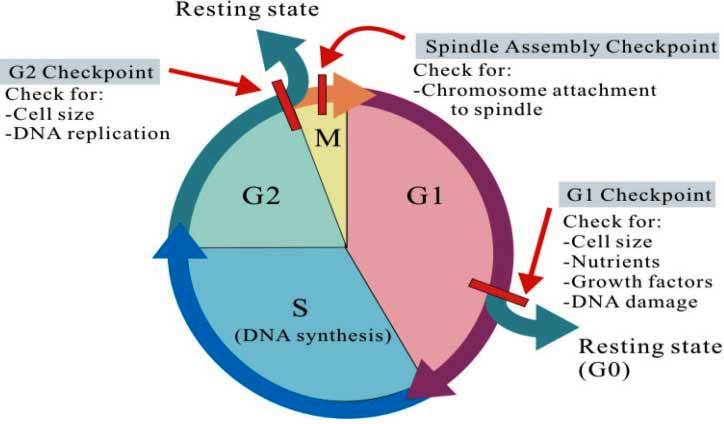
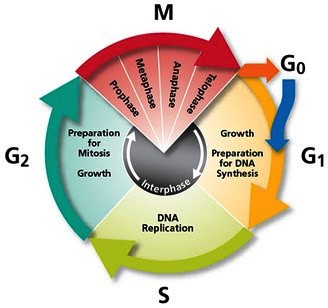
Η μεσόφαση αποτελείται από 3 διαδοχικές φάσεις, τη Growth 1 ή Gap1 (G1 ) τη σύνθεση (Synthesis) ή S και τη Growth 2 ή Gap2 (G2 ).
Α) Στη πρώτη φάση, G1 το κύτταρο βρίσκεται σε φάση ανάπτυξης, μαζεύει υλικά για να μεγαλώσει.
Τα χρωματοσώματα σ’ αυτή τη φάση είναι 46 στη “γραμμική” τους μορφή.
Η τεράστια πλειοψηφία των κυττάρων που διαιρούνται βρίσκεται σ’ αυτή τη φάση.
Στο τέλος της φάσης, όταν φτάσει σε επαρκές μέγεθος, υπάρχει ένα πρώτο σημείο ελέγχου (checkpoint 1) όπου αποφασίζεται αν το κύτταρο θα προχωρήσει στην επόμενη φάση, S.
Β) Επόμενη φάση είναι η φάση της σύνθεσης και διπλασιασμού του DNA (φάση S ή Synthesis).
Τα χρωματοσώματα σ’ αυτή τη φάση αποτελούνται από 46 ζεύγη ακριβώς ίδιων, αδελφών χρωματοσωμάτων (92 συνολικά) μπλεγμένων μεταξύ τους.
Επίσης σ’ αυτή τη φάση διπλασιάζεται και το κεντροσωμάτιο
(οργανίδιο που δημιουργεί οργανώνει τον κυτταροσκελετό).
Γ) Η τελευταία φάση της μεσόφασης, η G2, είναι η φάση της δεύτερης ανάπτυξης του κυττάρου.
Στο τέλος της φάσης, υπάρχει ένα δεύτερο σημείο ελέγχου, checkpoint 2, όπου αποφασίζεται αν το κύτταρο θα προχωρήσει στην επόμενη φάση, της μίτωσης.
Ελέγχεται δηλαδή αν το DNA έχει αναπαραχθεί ακριβώς, χωρίς καμιά βλάβη σ’ αυτό και αν το περιβάλλον του κυττάρου είναι ευνοϊκό (σε θρεπτικά στοιχεία και με επαρκή χώρο) για τη δημιουργία 2 θυγατρικών κυττάρων.
Και σ’ αυτή τη φάση τα χρωματοσώματα είναι 92, στην ίδια μορφή με του τέλους της προηγούμενης φάσης, S.
Η ΜΙΤΩΣΗ
Μετά τη μεσόφαση, ακολουθεί η “τελευταία” φάση του κυτταρικού κύκλου, η μίτωση, όπου γίνεται η διαίρεση του κυττάρου.
Η μίτωση είναι η διαίρεση του DNA του πυρήνα και η διαίρεση των υπολοίπων οργανιδίων του σωματικού κυττάρου (μη αναπαραγωγικού και μη τελικώς διαφοροποιημένου) κυττάρου, σε 2 ακριβώς ίδια θυγατρικά κύτταρα.
Η μίτωση γίνεται για ανάπτυξη και για ανανέωση- επιδιόρθωση των ιστών και αποτελεί σύντομη χρονικά φάση της ζωής των κυττάρων (διαρκεί συνήθως 8-24 ώρες).
Η μίτωση χωρίζεται, για λόγους περιγραφής, σε 5 φάσεις, την πρόφαση, τη προμετα-φαση, τη μετάφαση, την ανάφαση και την τελόφαση.
Η Πρόφαση:
Τα 92 χρωματοσώματα πυκνώνουν (παίρνουν το γνωστό σχήμα κεφαλαίου Χ) και τα δυο (θυγατρικά) κεντροσωμάτια με τους πρωτεϊνικούς μικροσωληνίσκους (spindle fibers) αρχίζουν να μετακινούνται σε δυο αντίθετες άκρες του κυττάρου.
Η Προ-Μετα–φαση: Σ’ αυτήν η μεμβράνη του πυρήνα γίνεται κομμάτια και οι spindle fibers ενώνονται με τα κεντρομερή των 46 διπλών ακριβώς ίδιων χρωματοσωμάτων (92 χρωματίδες).
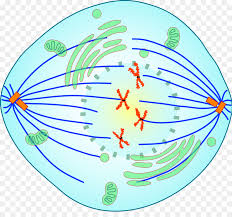
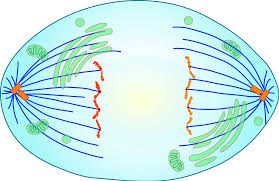
Η Μετάφαση: Τα 46 ζεύγη ίδιων χρωματοσωμάτων στοιχίζονται σε σειρά στον ισημερινό του κυττάρου.
Σ’ αυτή τη φάση, πριν τον διαχωρισμό, ελέγχεται αν όλα σχετικά με το DNA είναι εντάξει, και λέγεται Metaphase checkpoint ή Spindle checkpoint.
Η Ανάφαση: Σ’ αυτήν τα 46 ζεύγη ίδιων χρωματοσωμάτων διαχωρίζονται ταυτόχρονα και έλκονται προς τα 2 διαμετρικά αντίθετα κεντροσωμάτια, από τις spindle fibers.
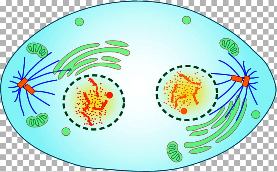
Η Τελόφαση: Τα χρωματοσωμάτα φτάνουν στους 2 πόλους του κυττάρου, οι spindle fibers “διαλύονται”, και δημιουργείται νέα πυρηνική μεμβράνη γύρω από την κάθε ομάδα χρωματοσωμάτων.
Στο τέλος της τελόφασης ένας δακτύλιος ινών Ακτίνης σφίγγει και τελικά διαχωρίζει το μητρικό κύτταρο (Cytokinesis) στα δυο νέα θυγατρικά κύτταρα.
Τα σημεία ελέγχου της κυτταρικής διαίρεσης στον κυτταρικό κύκλο είναι τρία. Και στα 3, πρωταρχικά ελέγχεται αν υπάρχει κάποια βλάβη στο DNA.
Στο 1ο σημείο ελέγχου, στο τέλος της φάσης G1, το κύτταρο ελέγχει επιπλέον, αν υπάρχουν οι προϋποθέσεις (εσωτερικές και εξωτερικές) για να προχωρήσει στην επόμενη φάση, S. Δηλαδή ελέγχεται αν το μέγεθος του κυττάρου είναι επαρκές και αν αυτό έχει όλα τα θρεπτικά συστατικά και αν υπάρχουν θετικά μηνύματα από το περιβάλλον
(π.χ. αυξητικοί παράγοντες).
Στο 2ο σημείο ελέγχου, στο τέλος της φάσης G2, το κύτταρο ελέγχει κυρίως, αν το DNA διπλασιάστηκε σωστά, στην προηγούμενη φάση S και αν αυτό παρουσιάζει βλάβες (π.χ. μεταλλάξεις).
Στο 3ο σημείο ελέγχου
(Metaphase checkpoint ή Spindle checkpoint)
στη μετάφαση, πριν τον διαχωρισμό των 46 ζευγών ίδιων χρωματοσωμάτων, ελέγχεται αν όλα σχετικά με το DNA είναι εντάξει, ώστε να γίνει ο διαχωρισμός των χρωματίδων.
Οι εντολές (θετικές ή αρνητικές) για το αν θα προχωρήσει ένα κύτταρο στην επόμενη φάση του κυτταρικού κύκλου προέρχονται από το εσωτερικό και από το εξωτερικό περιβάλλον του κυττάρου.
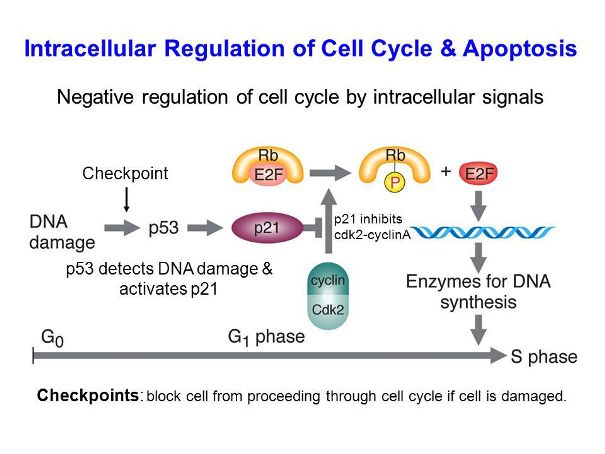
Όλοι οι θετικοί ρυθμιστές (παράγοντες ανάπτυξης) πρέπει να υπάρχουν και όλοι οι αρνητικοί ρυθμιστές (π.χ. οι πρωτεΐνες p53, p21, Rb (retinoblastoma protein) πρέπει να είναι απόντες ώστε να προχωρήσει το κύτταρο στην επόμενη φάση.
Οιαρνητικοίρυθμιστές-πρωτεΐνες, ελέγχονται από γονίδια που ονομάζουμε tumor suppressor genes.Αν αυτά τα γονίδια υποστούν μετάλλαξη και δεν εκφράζουν- δημιουργούν τις αντίστοιχες πρωτεΐνες, δημιουργείται καρκίνος.
Έτσι αν οι μηχανισμοί ελέγχου και επιδιόρθωσης αποτύχουν σε περίπτωση βλάβης του DNA και το κύτταρο καταφέρει να προχωρήσει στις επόμενες φάσεις του κύκλου, τότε δημιουργείται καρκινικό κύτταρο.
Οι θετικές εντολές π.χ. από παράγοντες ανάπτυξης αυξάνουν τη δραστηριότητα ουσιών όπως οι Κυκλίνες (Α, Β, D και Ε), οι Cdks, ενώ οι αρνητικές εντολές μειώνουν ή σταματούν τη δραστηριότητα τους.
Το σύμπλεγμα της πρωτεΐνης Κυκλίνης Β (Μ) και του ενζύμου Cdk, λέγεται MPF (Mitosis Promoting Factor).
Μόλις το κύτταρο καταφέρει να ξεπεράσει το σημείο ελέγχου, η στάθμη των κυκλινών πέφτει κατακόρυφα λόγω αποσύνθεσης τους.]
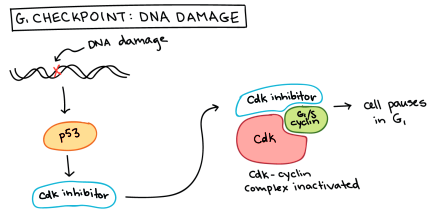
Σε βλάβη του DNA (π.χ. σπάσιμο και των δυο ελίκων ή DSB) αυξάνεται η πρωτεΐνη p53, που σταματά τον κυτταρικό κύκλο και επιστρατεύει διάφορα ένζυμα για να το επιδιορθώσουν. Αν δεν είναι εφικτή η επιδιόρθωση του DNA, η p53 προκαλεί απόπτωση (θάνατο) ή γήρανση λειτουργιών (senescence) του κυττάρου.
Στους καρκίνους το συχνότερα μεταλλαγμένο γονίδιο είναι αυτό που προκαλεί τη δημιουργία (εκφράζει) την πρωτεΐνη p53.
Συνεπώς αν λόγω της μετάλλαξης του γονιδίου της πρωτεΐνης p53 έχουμε απώλεια της λειτουργικότητας της, δεν επιδιορθώνεται το DNA μέσω των μηχανισμών DDR (δες πιο κάτω), οπότε γίνεται επιτρεπτό να δημιουργηθεί ο καρκίνος.
Μερικά κύτταρα είναι σε φάση ηρεμίας (quiescent stage) ή φάση G 0 (μηδέν), εκτός του κυτταρικού κύκλου. Σ’ αυτή τη φάση τα κύτταρα επιτελούν το έργο τους (π.χ. τα νευρικά κύτταρα μεταφέρουν τα σήματα), χωρίς να ετοιμάζονται για διαίρεση.
Στη φάση G 0 είναι:
α) όσα κύτταρα δεν διαιρούνται. Αυτά είναι τα τελικώς διαφοροποιημένα (όπως π.χ. τα νευρικά, τα σκελετικά μυϊκά κύτταρα, τα καρδιακά μυοκύτταρα κλπ.) και όσα δεν έχουν πυρήνα (π.χ. τα ερυθρά, τα αιμοπετάλια).
β) όσα κύτταρα (π.χ. ηπατοκύτταρα, σωματικά βλαστοκύτταρα κλπ.) περιμένουν τα κατάλληλα ερεθίσματα (και από ευνοϊκό περιβάλλον) για να μπουν – ξαναμπούν στον κυτταρικό κύκλο (στη φάση G1).
Παράδειγμα αυτών, είναι τα παρθένα Τ λεμφοκύτταρα που περιμένουν στους λεμφαδένες να ενεργοποιηθούν, αν ποτέ παρουσιαστεί σε αυτά το κατάλληλο αντιγόνο εισβολέα μικροοργανισμού, από τα Δενδριτικά κύτταρα.
γ) όσα κύτταρα έχουν τελειώσει με τις κυτταρικές διαιρέσεις τους και δεν μπορούν να διαιρεθούν άλλο, οπότε βρίσκονται σε “γήρανση“ από πλευράς διαιρέσεων
Όσα κύτταρα είναι σ’ αυτή τη φάση, δεν μπορούν να ξαναμπούν στον κυτταρικό κύκλο και τελικά καταλήγουν σε θάνατο.
Η replicative Senescence είναι η ανικανότητα του κυττάρου να ξαναδιαιρεθεί, ενώ η γήρανση του κυττάρου (Senescence) είναι η μη αποδοτική λειτουργία του λόγω συσσώρευσης βλαβών με την πάροδο του χρόνου.
Τα κύτταρα διαφόρων ηλικιών μπορούν να παρουσιάσουν replicative Senescence και ίσως είναι και μηχανισμός προστασίας του οργανισμού για εξάλειψη (από το ανοσοποιητικό) όσων κυττάρων έχουν παρουσιάσει βλάβη στο DNA τους.
Η replicative senescence όσων κυττάρων διαιρούνται όπως και των ενήλικων βλαστοκυττάρων (που αντέχουν περισσότερους κύκλους διαίρεσης) προκαλούν τελικά, αργότερα στη ζωή τη γήρανση του οργανισμού.
Αυτό γίνεται όταν τα κύτταρα με replicative senescence συσσωρεύονται ή/και αν το γερασμένο ανοσοποιητικό δεν μπορεί να τα καταστρέψει.
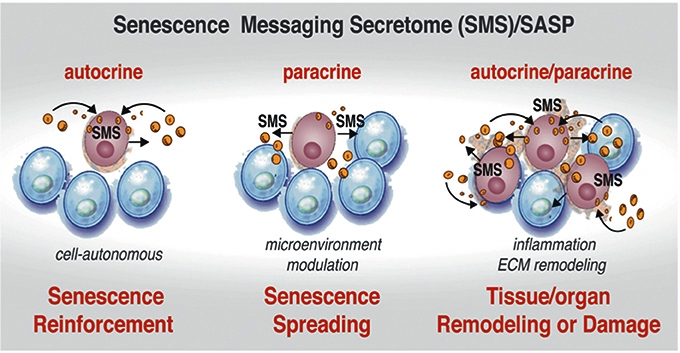
Πριν καταλήξουν τελικά στο θάνατο τα κύτταρα που είναι σε φάση replicative senescence, εκκρίνουν πάρα πολλές ουσίες που λέγονται SASP (senescence–messaging secretome) και είναι φλεγμονώδεις κυτοκίνες, παράγοντες ανάπτυξης, ουσίες που έλκουν διάφορα λευκοκύτταρα για εξάλειψη του γερασμένου κυττάρου κλπ.
Μερικές από αυτές τις ουσίες (SASP) δυστυχώς δρουν βλαπτικά στα γειτονικά τους κύτταρα.
[Υπ’ όψιν ότι σε περιπτώσεις βλάβης ή τραυματισμού των ιστών δημιουργείται προσωρινή- “ωφέλιμη” senescence για την επιδιόρθωση τους.]
Τα κύτταρα μπαίνουν σε φάση replicative senescence, όταν τα τελομερή των χρωματοσωμάτων τους φτάσουν σε ένα κρίσιμα μικρό μήκος, για να μην υπάρξουν βλάβες στο DNA τους,.
Το κρίσιμα μικρό μήκος των τελομερών συμβαίνει, έρχεται μετά από διαδοχικές φθορές τους από τις πολλές διαιρέσεις του κυττάρου (περίπου 40-70).
Ο μέγιστος αριθμός των διαιρέσεων που μπορεί συμβούν σε ένα κύτταρο πριν την είσοδο του στη φάση της replicative senescence λέγεται και Hayflick limit.
Όσο περνά η ηλικία του οργανισμού τόσο αυξάνονται τα κύτταρα που μπαίνουν στη φάση της replicative senescence, πιθανόν όμως αυτό να γίνεται για να προστατευθεί το DNA από βλάβες και μεταλλάξεις (αν συνεχίζονταν οι διαιρέσεις), ώστε να μην δημιουργηθεί καρκίνος.
Όσο περισσότερες διαιρέσεις υφίστανται τα ενήλικα σωματικά κύτταρα, τόσο περισσότερες μεταλλάξεις αθροίζονται σ’ αυτά, οπότε αυξάνεται ο κίνδυνος καρκίνου.
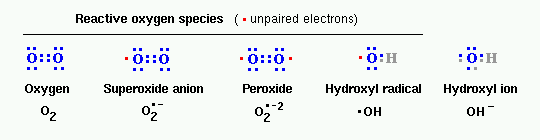
ΟΙ ΕΛΕΥΘΕΡΕΣ ΡΙΖΕΣ ΟΞΥΓΟΝΟΥ
(REACTIVE OXYGEN SPECIES ή ROS)
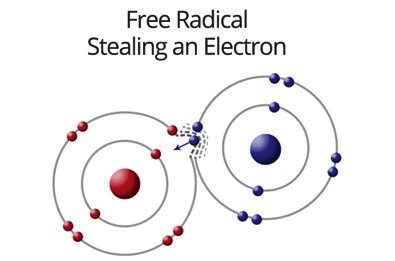
Οι ROS είναι μικρά μόρια ελεύθερων ριζών Οξυγόνου (ή μορίων Οξυγόνου που μετατρέπονται σε ελεύθερες ρίζες) που επιζητούν να κλέψουν από αλλού ηλεκτρόνιο, λόγω του ότι έχουν ένα ή περισσότερα αζευγάρωτα (μονός αριθμός) ηλεκτρόνια.
Οι ROS δημιουργούνται φυσιολογικά στο σώμα σε μικρές ποσότητες και είναι χρήσιμες σ’ αυτές τις ποσότητες στο κύτταρο σαν ρυθμιστές και σηματοδότες.
Π.χ. χρησιμοποιούνται από τα φαγοκύτταρα για την εξόντωση μικροβίων, χρησιμοποιούνται για την ενεργοποίηση ορισμένων γονιδίων, χρησιμοποιούνται για προσέλκυση και άλλων αιμοπεταλίων (μαζεύονται σε διάβρωση του ενδοθηλίου των αγγείων) κλπ.
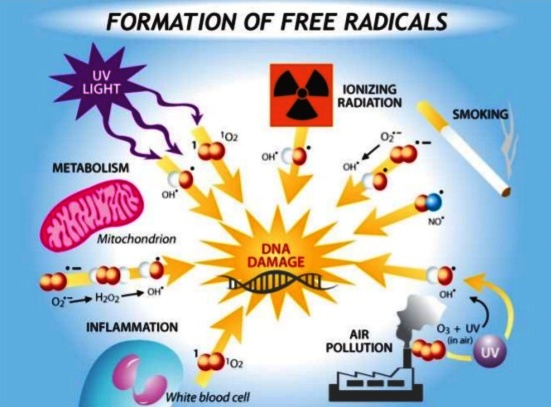
Όμως οι ROS σε καταστάσεις stress (π.χ. φλεγμονής, ακτινοβολίας, ρύπανσης της ατμόσφαιρας κλπ.) αυξάνονται παθολογικά και υπέρμετρα, δεν προλαβαίνουν να εξουδετερωθούν από αντιοξειδωτικούς μηχανισμούς όπως η glutathione, οπότε προκαλούν βλάβες στο κύτταρο που αναφέρονται σαν οξειδωτικό stress.
Το οξειδωτικό stress, δηλαδή οι βλάβες στο κύτταρο από τις ROS, γίνονται επειδή οι ROS κλέβουν το ηλεκτρόνιο που τους λείπει από τα λιπίδια των μεμβρανών των κυττάρων (εξωτερική, μιτοχόνδρια, ενδοπλασματικό δίκτυο κλπ.) ή από τις πρωτεΐνες ή από το DNA (προκαλούν μεταλλάξεις) ή από το RNA, προκαλώντας βλάβη ή και θάνατο σ’ αυτά.
Το οξειδωτικό stress συμμετέχει στη δημιουργία της αθηρωμάτωσης, του εμφράγματος, της καρδιακής ανεπάρκειας, του καρκίνου, της νόσου του Alzheimer, της νόσου του Parkinson, της υπογονιμότητας του άντρα κλπ.
Οι ROS
παράγονται από εξωγενείς αιτίες (επιγενετικά) από τη μόλυνση της ατμόσφαιρας, το κάπνισμα, την ακτινοβολία κλπ., όμως παράγονται και ενδογενώς σε ένα ελάχιστο ποσοστό κατά τη δημιουργία του “καυσίμου του κυττάρου” (ΑΤΡ) από τα μιτοχόνδρια.
ΟΙ ΒΛΑΒΕΣ ΤΟΥ DNA ΚΑΙ Η ΦΑΣΗ
ΤΗΣ ΓΗΡΑΝΣΗΣ
(SENESCENCE)
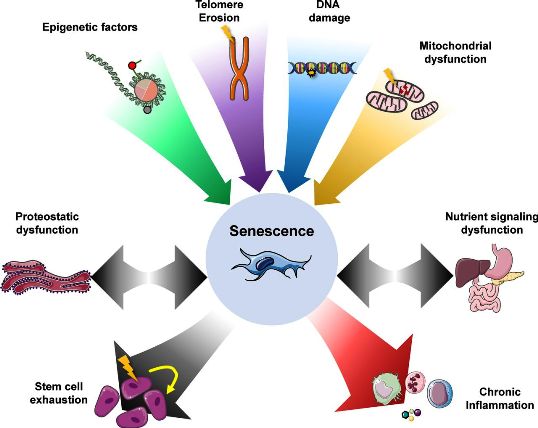
Η γήρανση του οργανισμού οφείλεται κυρίως σε αθροιστικές βλάβες του DNA, αλλά και των άλλων συστατικών, και οργανιδίων του κυττάρου (π.χ. μιτοχόνδρια).
Τα κύτταρα μπαίνουν σε φάση γήρανσης (senescence) όταν αρχίζει να προκαλείται βλάβη στο DNA τους (και άσχετα από τον αριθμό των κυτταρικών τους διαιρέσεων) από ογκογονίδια (oncogenes) ή από αύξηση των ελευθέρων ριζών Οξυγόνου (ROS ή Reactive Oxygen Species) κλπ.
Επίσης σε φάση γήρανσης (senescence) μπαίνουν και όσα κύτταρα βρίσκονται στο τέλος της φάσης “γήρανσης” από πλευράς διαιρέσεων (replicative senescence) λόγω της μείωσης του μήκους των τελομερών των χρωματοσωμάτων σε οριακό σημείο.
Η Senescence από ογκογονίδια λέγεται Oncogene Induced Senescence (OIS) και πολλές φορές τα κύτταρα αυτά ξαναμπαίνουν στον κυτταρικό κύκλο σαν καρκινικά κύτταρα.
Τα ογκογονίδια είναι γονίδια που αυξήθηκε η ενεργοποίηση τους ή δημιουργήθηκαν από μεταλλάξεις και που μπορούν να προκαλέσουν καρκίνο.
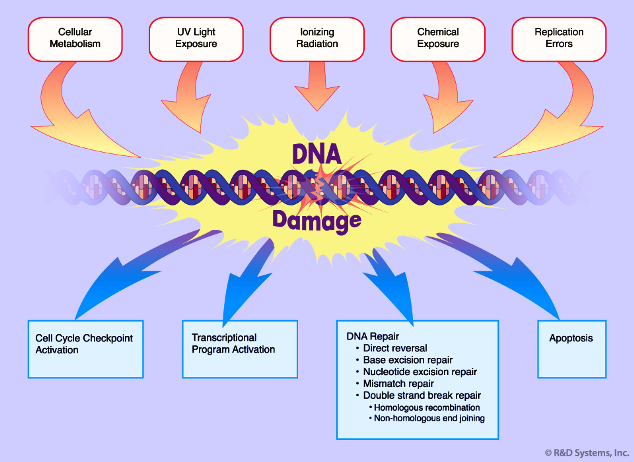
Οι βλάβες του DNA που γίνονται κάθε μέρα είναι δεκάδες χιλιάδες σε κάθε κύτταρο, όμως σχεδόν όλες επιδιορθώνονται εκτός από περίπου 1 ανά 5000, που παραμένουν μόνιμες.
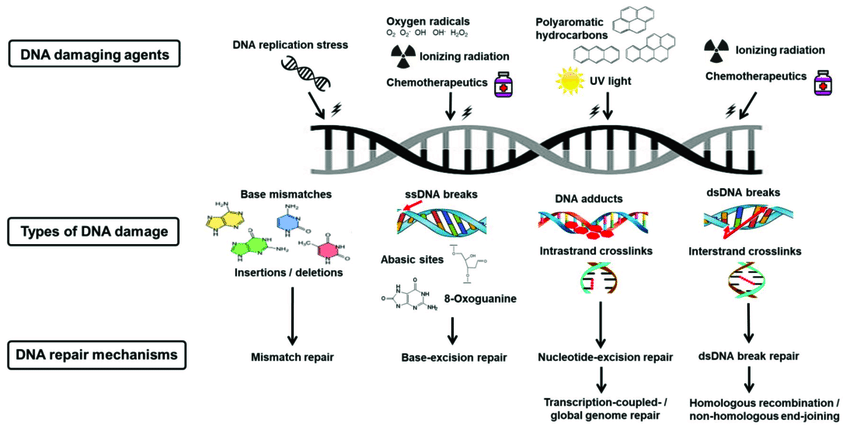
Το DNA μας υφίσταται συνεχείς βλάβες τόσο από ΕΝΔΟΓΕΝΕΙΣ παράγοντες (π.χ. βλάβη από τις ROS που προέρχονται από το συνηθισμένο μεταβολισμό, από λάθη αντιγραφής του DNA) όσο και από
ΕΞΩΓΕΝΕΙΣ παράγοντες π.χ. υπεριώδης ηλιακή ακτινοβολία, άλλα είδη ακτινοβολίας, ορισμένες τοξίνες, ορισμένες χημικές αρωματικές ουσίες όπως το βενζόλιο και το τολουένιο, από ιώσεις ..
Οι βλάβες του DNA μπορεί να είναι αλλαγή ή απώλεια νουκλεοτιδίου- βάσης, “σπάσιμο” της μιας ή και των δυο ελίκων του (μπορεί να οδηγήσει σε μετάλλαξη).
Για να διορθωθούν οι βλάβες του DNA, το κύτταρο έχει αναπτύξει μηχανισμούς που τις ανιχνεύουν και τις επιδιορθώνουν. Αυτοί λέγονται μηχανισμοί DDR (DNA Damage Response).
Αν ο ρυθμός των βλαβών του DNA είναι μεγαλύτερος από το ρυθμό της επιδιόρθωσης τους, ή αν το γονίδιο του DNA που έχει υποστεί τη μόνιμη βλάβη, είναι σημαντικό γονίδιο (π.χ. γονίδιο που εμποδίζει τη δημιουργία όγκου, ή γονίδιο που επιδιορθώνει το DNA), οι βλάβες στο DNA συσσωρεύονται, οπότε το κύτταρο μπορεί να μπει σε φάση γήρανσης ή προγραμματισμένου θανάτου (απόπτωση) ή καρκίνου.
Υπ’ όψιν ότι μια δίαιτα περιορισμένων θερμίδων προκαλεί βελτίωση των μηχανισμών επιδιόρθωσης των βλαβών του DNA και παράταση στη ζωή
πηγη Πισσαρίδης Κώστας
ΕΝΔΕΙΚΤΙΚΗ ΒΙΒΛΙΟΓΡΑΦΙΑ
https://www.sciencedirect.com/science/article/pii/S0092867417305469
https://www.frontiersin.org/articles/10.3389/fgene.2017.00220/full



.jpg)

Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου